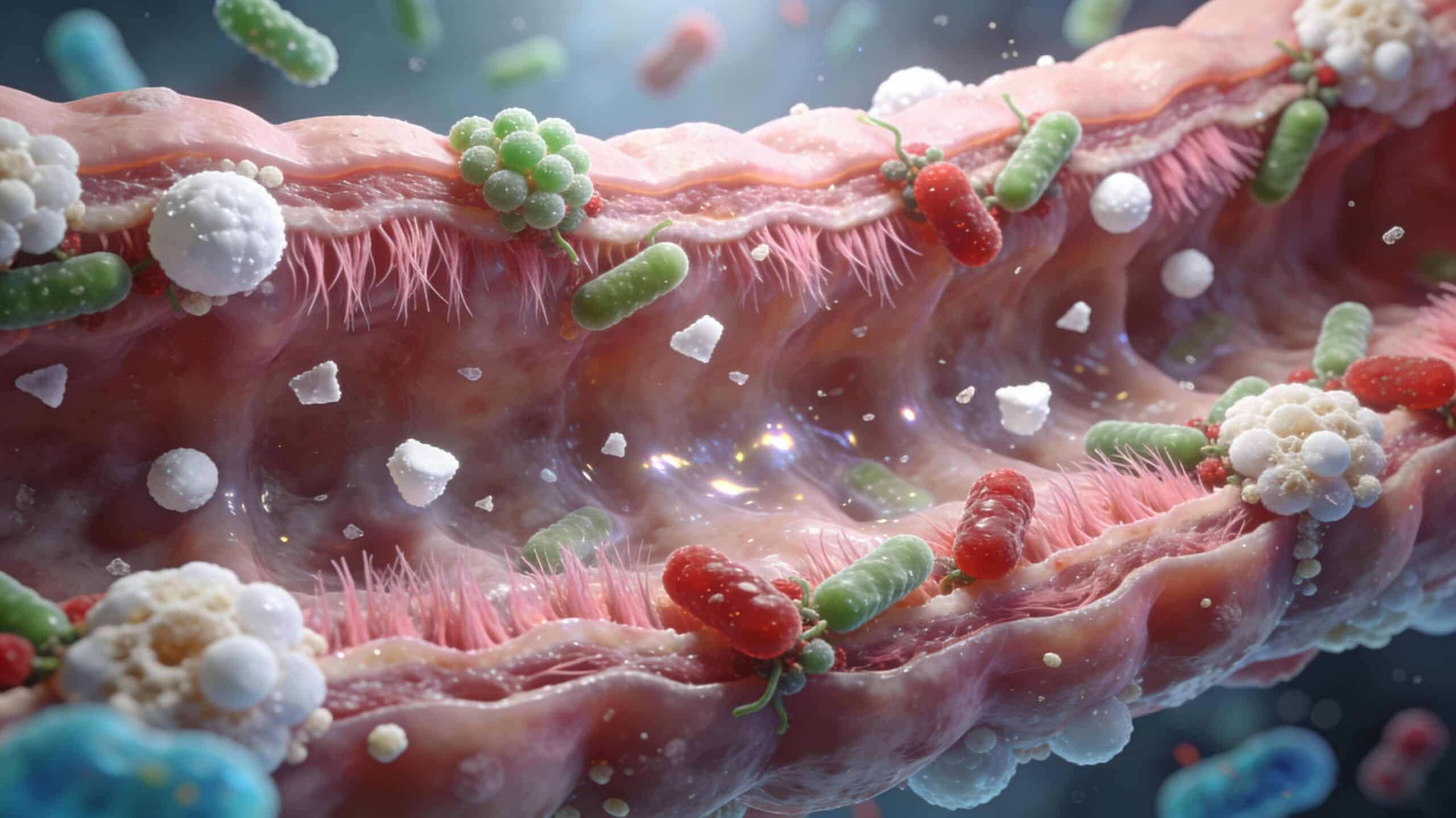
Las paredes celulares de levadura se han consolidado como una de las herramientas más interesantes para modular la microbiota intestinal, mejorar la integridad de la mucosa y apoyar el rendimiento productivo en sistemas intensivos.
Desde el punto de vista del nutricionista, no son simplemente “MOS y β‑glucanos”: su origen, composición, grado de digestibilidad y el proceso tecnológico de obtención marcan de forma muy clara la respuesta zootécnica.
¿Qué es exactamente una pared celular de levadura?
Las paredes celulares se obtienen a partir de levaduras del género Saccharomyces cerevisiae, tras un proceso de fermentación (vino, cerveza, etanol de caña de azúcar, etc.), lisis celular (autólisis, enzimas, temperatura, sal) y separación de la fracción citoplasmática.
A diferencia de:
- Levadura viva: actúa principalmente vía metabolismo (consumo de O₂, producción de metabolitos).
- Levadura entera inactiva/autolisada: aporta pared y contenido intracelular, pero con menor concentración de polisacáridos funcionales.
- Pared celular purificada: es una fracción concentrada en glucomananos (MOS + β‑glucanos).
Composición y estructura: mucho más que “MOS y β‑glucanos”
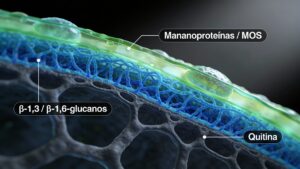
La pared celular de S. cerevisiae presenta una estructura en capas:
Capa externa: rica en mananoproteínas y mananooligosacáridos (MOS), con cadenas de manosa unidas mayoritariamente por enlaces α‑1,3 y α‑1,6.
Capa interna: red de β‑glucanos (β‑1,3 y β‑1,6) que confiere resistencia mecánica.
Esqueleto estructural: pequeña fracción de quitina.
Proteínas asociadas a membrana, minerales y humedad completan el conjunto.
De forma típica, en paredes procedentes de levadura de caña de azúcar se encuentran rangos medios como:
- Glucomananos totales: 50–60% de la materia seca.
- MOS: 20–25% de la MS.
- β‑glucanos: 30–35% de la MS.
- Proteína cruda: alrededor de 35%.
- Cenizas: ≈5–8%.
Cuando se habla de “glucomananos”, en este contexto se está integrando la fracción MOS + β‑glucanos, que es precisamente la que explica la mayor parte de los efectos funcionales.
Mecanismos de acción principales
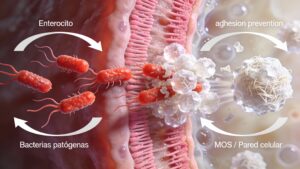
Aglutinación y exclusión de patógenos (MOS)
Los MOS actúan como “señuelos” para bacterias con fimbrias tipo 1 (por ejemplo, cepas de E. coli y Salmonella spp.). La manosa en configuración α‑1,3 y α‑1,6 se une a las lectinas de la superficie bacteriana, promoviendo la aglutinación y dificultando la adhesión a enterocitos.
En ensayos in vitro con paredes de levadura ricas en MOS se ha documentado:
- Aglutinación de E. coli en el 95% de las cepas evaluadas.
- Aglutinación de Salmonella spp. en el 100% de las cepas probadas.
Este efecto se traduce en:
- Menor colonización de mucosa.
- Potencial reducción de diarreas asociadas a E. coli y Salmonella en etapas críticas (pre‑ y post‑destete, primeras semanas de vida, periparto).
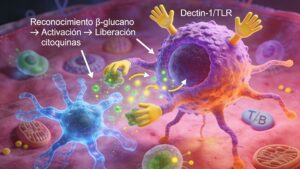
Modulación de la respuesta inmune (β‑glucanos)
Los β‑glucanos de levadura son polisacáridos de D‑glucosa con enlaces β‑1,3 y ramificaciones β‑1,6, reconocidos por receptores específicos en células del sistema inmune innato (macrófagos, células dendríticas).
En modelos ex vivo con yeyuno de pollos desafiados con LPS se ha observado que la suplementación con pared celular de levadura:
- Aumenta la expresión de citoquinas como IL‑1β, IL‑6 y TNF‑α y del receptor TLR‑4 en ausencia de desafío, indicando un “priming” del sistema inmune.
- Bajo desafío con LPS, modula la respuesta evitando una reacción excesiva, lo que sugiere un efecto inmunomodulador más que simplemente estimulante, ayudando a limitar el coste energético de la inflamación.
Adsorción de micotoxinas
Los β‑glucanos también presentan afinidad por diversas micotoxinas. En pruebas in vitro con paredes de levadura se ha observado:
- Fuerte capacidad de adsorción de zearalenona en pH 3,0 y 6,5 (pH gástrico e intestinal).
- Contribución positiva en la reducción de aflatoxina B1.
- Efectos relevantes sobre DON y fumonisina, si bien no tan marcados como frente a zearalenona.
La interacción se basa en:
- Estructuras helicoidales del β‑1,3‑D‑glucano que permiten una asociación estable con la micotoxina.
- Interacciones por puentes de hidrógeno y fuerzas de Van der Waals.
Microbiota e integridad intestinal
Las paredes celulares ejercen un doble efecto sobre el ecosistema intestinal:
- Sustrato prebiótico: los MOS pueden ser fermentados por géneros como Lactobacillus y Bifidobacterium, favoreciendo bacterias ácido-lácticas y la producción de ácidos grasos de cadena corta.
- Efecto estructural sobre mucosa: en diferentes especies se han descrito:
-
- Aumento de la altura de vellosidades y de la relación vellosidad:cripta.
- Reducción de la profundidad de criptas (menor recambio celular, menor coste energético).
- Aumento de la expresión de proteínas de unión estrecha (tight junctions) en intestino delgado.
En ponedoras comerciales y tilapia del Nilo suplementadas con paredes de levadura se han observado precisamente estos cambios histológicos, asociados a una mejor capacidad de absorción de nutrientes.
Calidad de la pared de levadura: por qué no todas funcionan igual
Origen de la levadura y grosor de pared
El tipo de fermentación condiciona de manera decisiva la arquitectura y la digestibilidad de la pared celular:
- Levaduras de panadería: condiciones de menor estrés, paredes más finas y, en general, más fácilmente digestibles.
- Levaduras de cerveza: situación intermedia.
- Levaduras de etanol de caña de azúcar: sometidas a alto estrés osmótico y alcohólico, desarrollan paredes más gruesas y resistentes, con mayor contenido estructural de β‑glucanos y MOS, pero MENOR digestibilidad intrínseca.
Esto implica dos cosas importantes para nutrición animal:
- Desde el punto de vista del animal, una pared más gruesa de levadura de caña de azúcar, si no se procesa bien, se digiere menos que una pared de levadura panaria o de cervecería.
- Desde el punto de vista tecnológico, si se aplica un proceso de lisis/autólisis bien diseñado, se puede romper esa pared más gruesa y liberar una fracción muy rica en glucomananos funcionales, con alta capacidad de aglutinación de patógenos, modulación inmune y adsorción de micotoxinas.
Por eso, no basta con preguntar “¿de qué levadura viene?”, sino cómo se ha procesado esa levadura para transformar una pared muy gruesa (poca digestibilidad de partida) en un ingrediente funcional disponible en el tracto gastrointestinal.
Proceso de autólisis y digestibilidad funcional
La lisis celular (por sal, enzimas, temperatura o combinaciones) es crítica cuando se trabaja con levaduras de caña de azúcar:
- Una pared más gruesa y resistente es más difícil de romper y, si el proceso es insuficiente, gran parte de los MOS y β‑glucanos queda “encerrada” en una matriz poco accesible.
- Cuando el proceso está optimizado, se consigue:
- Exponer mejor los MOS en la superficie, aumentando su capacidad de aglutinación de E. coli y Salmonella.
- Hacer más accesibles los β‑glucanos a los receptores inmunitarios intestinales.
- Ajustar la fracción indigerible de manera que actúe como fibra funcional/prebiótica, sin comprometer la utilización de nutrientes de la dieta.
En resumen, las levaduras de caña tienen MENOR digestibilidad intrínseca de pared que las de panadería o de cervecería, precisamente porque su pared es más gruesa.
El valor añadido está en transformar esa desventaja inicial en una fortaleza mediante un buen proceso tecnológico, obteniendo una pared celular estandarizada, rica en glucomananos funcionales y con una fracción suficiente “expuesta” para ejercer sus efectos en el intestino.
En otras palabras, no basta con conocer el “% de MOS y β‑glucanos en etiqueta”: la fracción realmente funcional depende del origen y de cómo se ha roto la pared.
Para el nutricionista, la consecuencia práctica es clara: cuando se comparan productos comerciales, deben utilizarse métodos analíticos homogéneos y adaptados al tipo de levadura, o la comparación entre etiquetas puede ser engañosa.
Metodología analítica
La cuantificación de glucomananos, MOS y β‑glucanos no es trivial:
- Muchos métodos comerciales fueron desarrollados originalmente para levaduras panarias, con paredes más finas.
- Aplicados a levaduras de caña de azúcar, pueden infraestimar el contenido real de β‑glucanos y MOS al no romper completamente la estructura.
Por ello, algunos fabricantes han desarrollado métodos internos basados en la composición global de la levadura, combinando análisis bromatológicos (proteína, cenizas, humedad, fibra) e información de literatura y bases de datos históricas para estimar de forma más realista los glucomananos totales.
Evidencias en diferentes especies
Rumiantes lecheros
En vacas lecheras Holstein, la suplementación con 10 g/animal/día de pared de levadura ha mostrado efectos especialmente evidentes en inicio de lactación (≤120 días en leche):
- Incremento de la producción diaria de leche en ≈3,45 kg/vaca/día en comparación con el control.
- Mejores perfiles de metabolitos energéticos y parámetros bioquímicos relacionados con función hepática.
En el periodo de preparto, la suplementación con paredes se ha asociado a:
Aumento de la producción de calostro en ≈34% (7,5 vs 5,6 kg), sin cambios significativos en la concentración de IgG, lo que implica mayor cantidad total de inmunoglobulinas disponibles para el ternero.
En terneros destetados, dosis en torno a 0,16% de pared de levadura en la dieta durante 60 días dieron lugar a:
- Mayor longitud, anchura y superficie de papilas ruminales en el saco ventral del rumen.
- Incremento de la altura de vellosidades y de la relación vellosidad:cripta en intestino delgado.
- Aumento de la expresión de proteínas de oclusión en íleon y yeyuno, lo que sugiere una mejor integridad de barrera.
Estos resultados son particularmente relevantes en el estrés del destete y en transiciones bruscas de dieta líquido–sólido.
Pequeños rumiantes
Aunque la evidencia específica en ovino/caprino es más limitada, el mecanismo de acción frente a E. coli y Salmonella justifica su uso en estrategias para reducir colibacilosis neonatal.
En la práctica, se han propuesto esquemas como:
- Ovejas preparto: en torno a 6 g/día de pared de levadura, buscando reducir la carga bacteriana entérica en la madre y mejorar cantidad y calidad del calostro.
- Corderos lactantes: 3 g/día como apoyo en fases de alta presión infecciosa.
El objetivo no es “esterilizar” el ambiente, sino reducir la presión de infección y reforzar al mismo tiempo la barrera intestinal de madre y cría.
Aves de corral
Pollos de engorde
En pollos COBB 500 suplementados con niveles de 0,5–1,5 kg/T de pared de levadura se ha observado una mejora lineal de la ganancia de peso (tanto a 21 como a 35 y 41 días), índice de conversión (reducciones claras frente al control) e índice de eficiencia productiva (IEP), sin impacto negativo en viabilidad ni en rendimiento de canal.
En paralelo, se registró una reducción de la excreción de fósforo en la cama, con tendencia a menor excreción de nitrógeno, lo que puede tener implicaciones ambientales y de manejo de cama.
Ensayos in vitro con combinación de pared de levadura y levadura autolisada mostraron una disminución de la multiplicación de Salmonella Enteritidis y E. coli aviar patógena a partir de las 4 horas post-inoculación, siendo el efecto mayor cuanto más alta la dosis (hasta 0,68 kg/T equivalente en el modelo).
Estudios de microbiota en pollos desafiados y no desafiados con Salmonella Heidelberg mostraron que la inclusión de paredes celulares redujo la abundancia de Escherichia coli y Salmonella en comparación con animales no suplementados, moduló positivamente biomarcadores beneficiosos como Lactobacillus aviarius, Butyricicoccus pullicaecorum y determinados géneros productores de butirato y disminuyó la presencia de Clostridium spp. patógenos, Streptococcus y otros biomarcadores negativos.
Gallinas ponedoras
En gallinas ponedoras comerciales , la inclusión de 1 kg/T de pared de levadura en sustitución de un probiótico estándar ha mostrado un aumento del 8,43% en la producción de bandejas de huevos respecto al inicio del ensayo (vs. 5,46% en el control), menos huevos sucios (−58%) y rotos (−15%), con mayor proporción de bandejas completamente limpias (≈5,4 veces más que el control) y mejor persistencia de la postura tras periodos de estrés ambiental.
A nivel intestinal, en ponedoras de 65 semanas suplementadas se observó una mayor relación vellosidad:cripta en yeyuno (aumento significativo), una reducción de la profundidad de criptas, indicando menor recambio celular y una mejora global de la estructura intestinal, con potencial para un uso más eficiente de la dieta.
Acuicultura: tilapia del Nilo
En tilapia del Nilo suplementada con paredes de levadura a 2 kg/T de pienso se describieron un incremento de la ganancia de peso corporal en ≈18,7% en la fase de 150–250 g, frente al control, una reducción del depósito de grasa visceral en ≈6,2% y un aumento de la altura de vellosidades intestinales en ≈12,6%, lo que se traduce en mejor capacidad absortiva.
Estos resultados son especialmente interesantes en dietas vegetales ricas en polisacáridos no amiláceos y potencialmente más irritantes para la mucosa.
Recomendaciones prácticas de uso
Tomando como referencia rangos de uso habituales de paredes de S. cerevisiae:
- Aves (broilers, ponedoras, reproductoras)
Habitualmente entre 0,5 y 2,0 kg/T según presión de desafío, objetivo (rendimiento, calidad de huevo, control de cama) y presencia de otros aditivos. - Porcino
Rangos similares, 1,0–2,0 kg/T, especialmente en lechones y cerdas en transición, aunque la dosis óptima dependerá del perfil sanitario y del programa de aditivos. - Rumiantes jóvenes (terneros)
Aproximadamente 4–20 g/animal/día, en función de peso vivo y fase (transición leche‑starter, post‑destete). - Vacas de leche
En torno a 10 g/vaca/día en inicio de lactación; dosis específicas en preparto dependerán de la estrategia de manejo del periodo seco y del uso combinado con otros aditivos (probióticos, tampones, etc.). - Pequeños rumiantes
Valores orientativos de 6 g/día para ovejas en preparto y de 3 g/día para corderos, en situaciones de alta presión de E. coli. - Acuicultura (peces y camarones)
Habitualmente 0,5–2,0 kg/T, según densidad y calidad del agua.
Siempre debe considerarse:
- El contexto sanitario (historial de enteropatías, presencia de micotoxinas).
- La matriz de aditivos ya presente (probióticos, ácidos orgánicos, captadores específicos de micotoxinas).
- El coste por tonelada frente a alternativas (antibióticos, otros moduladores de microbiota).
Conclusión
Las paredes celulares de levaduras representan una herramienta sólida y respaldada por múltiples ensayos in vitro, ex vivo e in vivo para:
- Reducir la colonización intestinal de patógenos como E. coli y Salmonella mediante aglutinación mediada por MOS.
- Modular la respuesta inmune innata a través de β‑glucanos, mejorando la capacidad de respuesta sin desencadenar inflamaciones excesivas.
- Adsorber micotoxinas relevantes, especialmente zearalenona, complementando el uso de adsorbentes minerales.
- Mejorar la estructura e integridad de la mucosa intestinal, con vellosidades más altas y criptas menos profundas en aves, rumiantes jóvenes y peces.
- Apoyar el rendimiento productivo (más leche en inicio de lactación, más huevos, mejor conversión en broilers, mejor crecimiento en tilapia).
Para el formulador y el técnico de campo, el reto no es solo “usar paredes de levadura”, sino seleccionar fuentes con una composición bien caracterizada, métodos analíticos robustos y evidencia en las especies y fases de interés, e integrarlas de forma coherente en programas de salud y nutrición que buscan reducir la dependencia de antibióticos y mejorar la resiliencia de los animales frente a los desafíos sanitarios.

Bibliografía complementaria
- Orlean, P. (2012). Architecture and biosynthesis of the Saccharomyces cerevisiae cell wall. Genetics, 192(3), 775‑818.
- Klis, F. M., Boorsma, A., & De Groot, P. W. J. (2006). Cell wall assembly in Saccharomyces cerevisiae. Microbiology and Molecular Biology Reviews, 70(2), 317‑343.
- Aung, M., Ohtsuka, H., & Izumi, K. (2019). Effect of yeast cell wall supplementation on production performances and blood biochemical indices of dairy cows in different lactation periods. Animal Science Journal, 90(6).
- Mahasneh, O. K. (2023). Effect of yeast cell wall on gut health, immunity and milk production of dairy cows: A review. Jordan Journal of Biological Sciences, 16(4), 569‑582.
- Ma, J., Shah, A. M., Shao, Y., Wang, Z., Zou, H., & Kang, K. (2020). Dietary supplementation of yeast cell wall improves the growth performance and gut health of weaned calves. Animal Feed Science and Technology, 269, 114623.
- Kuzmenko, O., Zavertailo, I., Kuzmenko, A., & Kropyvka, Y. (2018). Influence of mannan oligosaccharides for getting high quality and ecologically safe swine products. Ukrainian Journal of Ecology, 8(1), 780‑785.
- Grant, S. A., Rychlik, J. L., & Mellata, M. (2023). Mannan‑based prebiotics modulate growth rate and energy metabolism of Escherichia coli and impact antibiotic efficacy. Frontiers in Animal Science, 4, 1069280.
- Polidoro, B. R., et al. (2025). Mannan oligosaccharide as an alternative to in‑feed antibiotics in broiler production: A meta‑analysis. British Poultry Science.
- Adli, D. N., Muslih, A. M., & Al‑Khafaji, N. J. (2023). Effects of oligosaccharides on performance, egg quality, intestinal profile, nutrient digestibility and immunity: A meta‑analysis in laying hens. Italian Journal of Animal Science, 22(1), 2281‑2296.
- Teng, P. Y., & Kim, W. K. (2021). Effects of a combination of mannan‑oligosaccharides and β‑glucans on growth performance, intestinal development, and immune response of broilers: A review. Poultry Science, 100(4), 101176.
- Abd‑Elsamee, M. O., et al. (2021). Impact of using different sources and levels of β‑glucan and mannan oligosaccharides on broiler performance. Advances in Animal and Veterinary Sciences, 9(11), 1851‑1862.
- Plazas, R. A. S., et al. (2024). Utilization of mannan oligosaccharides as antibiotic alternatives in laying hens. Poultry Science.
- Sutthi, N., Charoenwattanasak, S., Rattanarojpong, T., & Boonanuntanasarn, S. (2020). Effects of yeast (Saccharomyces cerevisiae) on growth performance, blood chemistry and body composition of Nile tilapia (Oreochromis niloticus) under salinity stress. Iranian Journal of Fisheries Sciences, 19(6), 3050‑3068.
- Amirul, M., et al. (2025). Dietary hydrolyzed yeast improves growth, gut health, and selective gene expression of Nile tilapia (Oreochromis niloticus). Aquaculture Reports.
- Spring, P., Wenk, C., Dawson, K. A., & Newman, K. E. (2000). The effects of dietary mannanoligosaccharides on cecal parameters and the concentrations of enteric bacteria in the ceca of salmonella‑challenged broiler chicks. Poultry Science, 79(2), 205‑211.
- Vetvicka, V., & Vetvickova, J. (2015). β‑Glucans as immunomodulators in animal models. Journal of Animal and Veterinary Advances, 14, 1‑12.