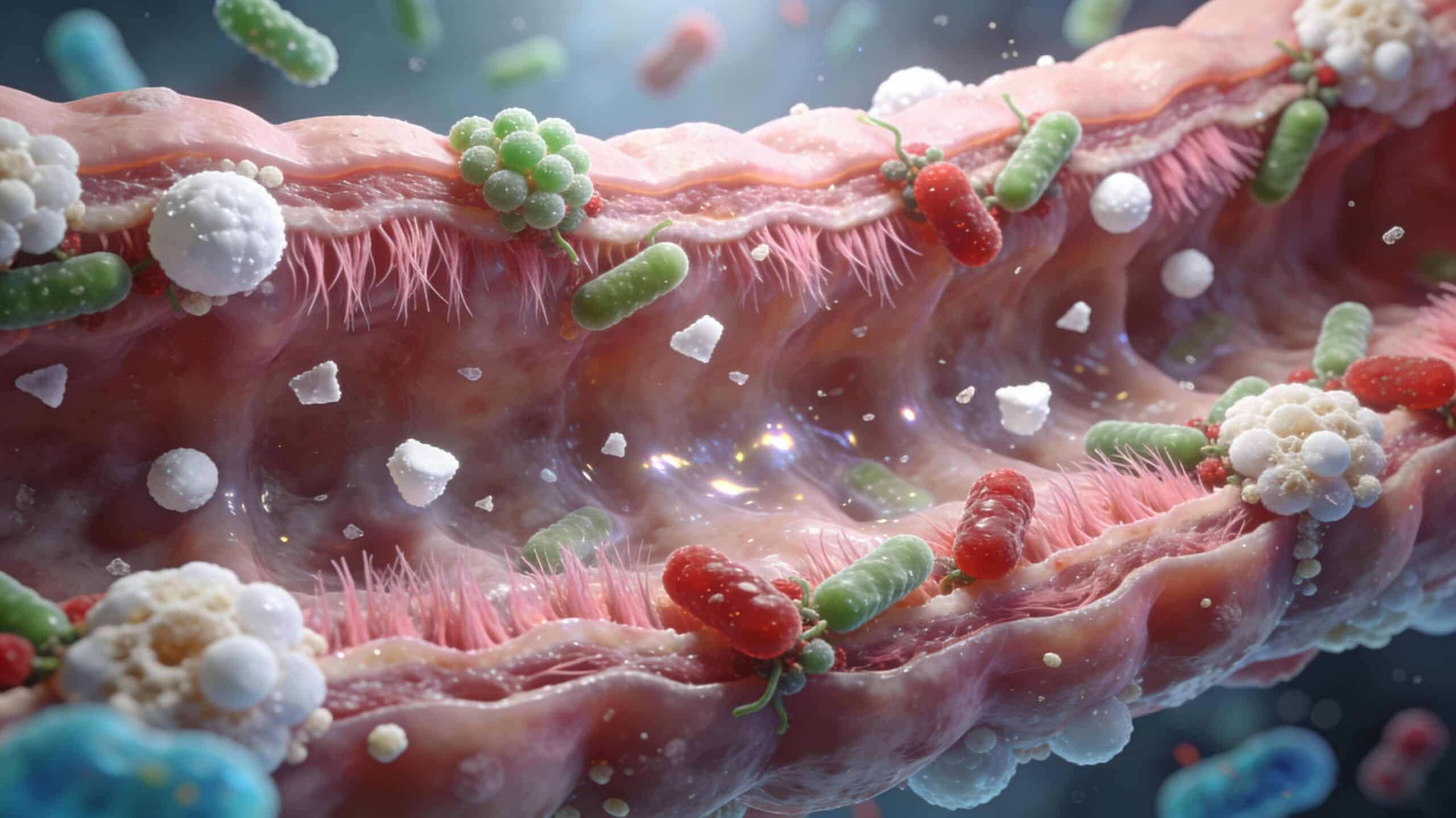
Les parets cel·lulars de llevat s’han consolidat com una de les eines més interessants per modular la microbiota intestinal, millorar la integritat de la mucosa i donar suport al rendiment productiu en sistemes intensius.
Des del punt de vista del nutricionista, no són simplement “MOS i β‑glucans”: el seu origen, composició, grau de digestibilitat i el procés tecnològic d’obtenció determinen de manera molt clara la resposta zootècnica.
Què és exactament una paret cel·lular de llevat?
Les parets cel·lulars s’obtenen a partir de llevats del gènere Saccharomyces cerevisiae, després d’un procés de fermentació (vi, cervesa, etanol de canya de sucre, etc.), lisi cel·lular (autòlisi, enzims, temperatura, sal) i separació de la fracció citoplasmàtica.
A diferència de:
- Llevat viu: actua principalment via metabolisme (consum d’O₂, producció de metabòlits).
- Llevat sencer inactiu/autolitzat: aporta paret i contingut intracel·lular, però amb una menor concentració de polisacàrids funcionals.
- Paret cel·lular purificada: és una fracció concentrada en glucomananos (MOS + β‑glucans).
Composició i estructura: molt més que “MOS i β‑glucans”
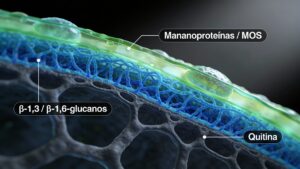
La paret cel·lular de S. cerevisiae presenta una estructura en capes:
Capa externa: rica en mananoproteínas y mananooligosacáridos (MOS), con cadenas de manosa unidas mayoritariamente por enlaces α‑1,3 y α‑1,6.
Capa interna: xarxa de β‑glucans (β‑1,3 i β‑1,6) que confereix resistència mecànica.
Esquelet estructural: petita fracció de quitina.
Proteïnes associades a la membrana, minerals i humitat completen el conjunt.
De manera típica, en parets procedents de llevat de canya de sucre es troben rangs mitjans com:
- Glucomananos totals: 50–60% de la matèria seca.
- MOS: 20–25% de la MS.
- β‑glucans: 30–35% de la MS.
- Proteïna crua: al voltant del 35%.
- Cendres: ≈5–8%.
Quan es parla de “glucomananos”, en aquest context s’està integrant la fracció MOS + β‑glucans, que és precisament la que explica la major part dels efectes funcionals.
Mecanismes d’acció principals
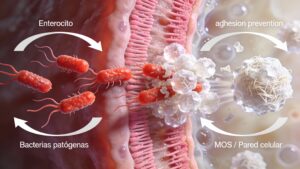
Aglutinació i exclusió de patògens (MOS)
Els MOS actuen com a “esquers” per a bacteris amb fímbries de tipus 1 (per exemple, soques d’E. coli i Salmonella spp.). La manosa en configuració α‑1,3 i α‑1,6 s’uneix a les lectines de la superfície bacteriana, promovent l’aglutinació i dificultant l’adhesió als enteròcits.
En assajos in vitro amb parets de llevat riques en MOS s’ha documentat:
- Aglutinació de E. coli en el 95% de les soques evaluades.
- Aglutinació de Salmonella spp. en el 100% de les soques provades .
Aquest efecte es tradueix en:
- Menor colonització de la mucosa.
- Potencial reducció de diarrees associades a E. coli i Salmonella en etapes crítiques (pre i post‑deslletament, primeres setmanes de vida, peripart).
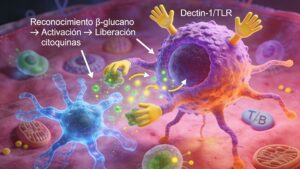
Modulació de la resposta inmune (β‑glucanos)
Els β‑glucans de llevat són polisacàrids de D‑glucosa amb enllaços β‑1,3 i ramificacions β‑1,6, reconeguts per receptors específics en cèl·lules del sistema immunitari innat (macròfags, cèl·lules dendrítiques).
En models ex vivo amb jejú d’aus de corral desafiaments amb LPS s’ha observat que la suplementació amb paret cel·lular de llevat:
- Augmenta l’expressió de citocines com IL‑1β, IL‑6 i TNF‑α i del receptor TLR‑4 en absència de desafiament, indicant un “priming” del sistema immunitari.
- Davant d’un desafiament amb LPS, modula la resposta evitant una reacció excessiva, cosa que suggereix un efecte immunomodulador més que simplement estimulant, ajudant a limitar el cost energètic de la inflamació.
Adsorció de micotoxines
Els β‑glucans també presenten afinitat per diverses micotoxines. En proves in vitro amb parets de llevat s’ha observat:
- Forta capacitat d’adsorció de zearalenona en pH 3,0 i 6,5 (pH gàstric i intestinal).
- Contribució positiva en la reducció d’aflatoxina B1.
- Efectes rellevants sobre DON i fumonisina, tot i que no tan marcats com davant la zearalenona.
La interacció es basa en:
- Estructures helicoïdals del β‑1,3‑D‑glucà que permeten una associació estable amb la micotoxina.
- Interaccions per ponts d’hidrogen i forces de Van der Waals.
Microbiota i integritat intestinal
Les parets cel·lulars exerceixen un doble efecte sobre l’ecosistema intestinal:
- Substrat prebiòtic: els MOS poden ser fermentats per gèneres com Lactobacillus i Bifidobacterium, afavorint les bacteris àcid-làctiques i la producció d’àcids grassos de cadena curta.
- Efecte estructural sobre la mucosa: en diferents espècies s’han descrit:
-
- Augment de l’alçada de les vellositats i de la relació vellositat:cripta.
- Reducció de la profunditat de les criptes (menor renovació cel·lular, menor cost energètic).
- Augment de l’expressió de proteïnes d’unió estreta (tight junctions) a l’intestí prim.
En gallines ponedores comercials i tilàpia del Nil suplementades amb parets de llevat s’han observat precisament aquests canvis histològics, associats a una millor capacitat d’absorció de nutrients.
Qualitat de la paret de llevat: per què no totes funcionen igual
Origen del llevat i gruix de la paret
El tipus de fermentació condiciona de manera decisiva l’arquitectura i la digestibilitat de la paret cel·lular:
- Llevats de fleca: condicions de menor estrès, parets més fines i, en general, més fàcilment digestibles.
- Llevats de cervesa: situació intermèdia.
- Llevats d’etanol de canya de sucre: sotmesos a un alt estrès osmòtic i alcohòlic, desenvolupen parets més gruixudes i resistents, amb un major contingut estructural de β‑glucans i MOS, però amb una MENOR digestibilitat intrínseca.
Això implica dues coses importants per a la nutrició animal:
- Des del punt de vista de l’animal, una paret més gruixuda de llevat de canya de sucre, si no es processa bé, es digereix menys que una paret de llevat panari o de cervesa.
- Des del punt de vista tecnològic, si s’aplica un procés de lisi/autòlisi ben dissenyat, es pot trencar aquesta paret més gruixuda i alliberar una fracció molt rica en glucomananos funcionals, amb una alta capacitat d’aglutinació de patògens, modulació immune i adsorció de micotoxines.
Per això, no n’hi ha prou amb preguntar “de quin llevat prové?”, sinó com s’ha processat aquest llevat per transformar una paret molt gruixuda (amb poca digestibilitat inicial) en un ingredient funcional disponible al tracte gastrointestinal.
Procés d’autòlisi i digestibilitat funcional
La lisi cel·lular (per sal, enzims, temperatura o combinacions) és crítica quan es treballa amb llevats de canya de sucre:
- Una paret més gruixuda i resistent és més difícil de trencar i, si el procés és insuficient, gran part dels MOS i β‑glucans queda “tancada” dins d’una matriu poc accessible.
- Quan el procés està optimitzat, s’aconsegueix:
- Exposar millor els MOS a la superfície, augmentant la seva capacitat d’aglutinació d’E. coli i Salmonella.
- Fer més accessibles els β‑glucans als receptors immunitaris intestinals.
- Ajustar la fracció indigerible de manera que actuï com a fibra funcional/prebiòtica, sense comprometre la utilització dels nutrients de la dieta.
En resum, els llevats de canya tenen una MENOR digestibilitat intrínseca de la paret que els de fleca o de cervesa, precisament perquè la seva paret és més gruixuda.
El valor afegit rau a transformar aquest desavantatge inicial en un punt fort mitjançant un bon procés tecnològic, obtenint una paret cel·lular estandarditzada, rica en glucomananos funcionals i amb una fracció suficientment “exposada” per exercir els seus efectes a l’intestí.
En altres paraules, no n’hi ha prou amb conèixer el “% de MOS i β‑glucans a l’etiqueta”: la fracció realment funcional depèn de l’origen i de com s’ha trencat la paret.
Per al nutricionista, la conseqüència pràctica és clara: quan es comparen productes comercials, s’han d’utilitzar mètodes analítics homogenis i adaptats al tipus de llevat, o bé la comparació entre etiquetes pot ser enganyosa. Quan vulguis, envia el següent fragment!
Metodologia analítica
La quantificació de glucomananos, MOS i β‑glucans no és trivial:
- Molts mètodes comercials van ser desenvolupats originalment per a llevats panaris, amb parets més fines.
- Aplicats a llevats de canya de sucre, poden infraestimar el contingut real de β‑glucans i MOS, ja que no trenquen completament l’estructura.
Per aquest motiu, alguns fabricants han desenvolupat mètodes interns basats en la composició global del llevat, combinant anàlisis bromatològiques (proteïna, cendres, humitat, fibra) i informació de la literatura i de bases de dades històriques per estimar d’una manera més realista els glucomananos totals.
Evidències en diferents espècies
Rumiants lactis
En vaques lleteres Holstein, la suplementació amb 10 g/animal/dia de paret de llevat ha mostrat efectes especialment evidents a l’inici de la lactació (≤120 dies en llet):
- Increment de la producció diària de llet en ≈3,45 kg/vaca/dia en comparació amb el control.
- Millors perfils de metabòlits energètics i paràmetres bioquímics relacionats amb la funció hepàtica.
En el període de prepart, la suplementació amb parets s’ha associat a:
Augment de la producció de calostre en ≈34% (7,5 vs 5,6 kg), sense canvis significatius en la concentració d’IgG, fet que implica una major quantitat total d’immunoglobulines disponibles per al vedell.
En vedells deslletats, dosis al voltant del 0,16% de paret de llevat en la dieta durant 60 dies van donar lloc a:
- Major longitud, amplada i superfície de les papil·les ruminals al sac ventral del rumen.
- Increment de l’alçada de les vellositats i de la relació vellositat:cripta a l’intestí prim.
- Augment de l’expressió de proteïnes d’oclusió a l’ili i al jejú, fet que suggereix una millor integritat de la barrera.
Aquests resultats són particularment rellevants en l’estrès del deslletament i en transicions brusques de dieta líquid–sòlid.
Petits remugants
Tot i que l’evidència específica en oví/caprí és més limitada, el mecanisme d’acció davant E. coli i Salmonella justifica el seu ús en estratègies per reduir la colibacil·losi neonatal.
A la pràctica, s’han proposat esquemes com ara:
- Ovelles prepart: al voltant de 6 g/dia de paret de llevat, amb l’objectiu de reduir la càrrega bacteriana entèrica a la mare i millorar la quantitat i la qualitat del calostre.
- Xais lactants: 3 g/dia com a suport en fases d’alta pressió infecciosa.
L’objectiu no és “esterilitzar” l’ambient, sinó reduir la pressió d’infecció i reforçar al mateix temps la barrera intestinal de la mare i la cria.
Aus de corral
Pollastres d’engreix
En pollastres COBB 500 suplementats amb nivells de 0,5–1,5 kg/T de paret de llevat s’ha observat una millora lineal del guany de pes (tant als 21 com als 35 i 41 dies), de l’índex de conversió (reduccions clares respecte al control) i de l’índex d’eficiència productiva (IEP), sense impacte negatiu en la viabilitat ni en el rendiment de canal.
En paral·lel, es va registrar una reducció de l’excreció de fòsfor a la llitja, amb tendència a una menor excreció de nitrogen, fet que pot tenir implicacions ambientals i de maneig de la llitja.
Assajos in vitro amb combinació de paret de llevat i llevat autolisat van mostrar una disminució de la multiplicació de Salmonella Enteritidis i E. coli aviària patògena a partir de les 4 hores post-inoculació, sent l’efecte més gran com més alta era la dosi (fins a 0,68 kg/T equivalent en el model).
Estudis de microbiota en pollastres desafiats i no desafiats amb Salmonella Heidelberg van mostrar que la inclusió de parets cel·lulars va reduir l’abundància d’Escherichia coli i Salmonella en comparació amb animals no suplementats, va modular positivament biomarcadors beneficiosos com Lactobacillus aviarius, Butyricicoccus pullicaecorum i determinats gèneres productors de butirat, i va disminuir la presència de Clostridium spp. patógenos , Streptococcus i altres biomarcadors negatius
Gallines ponedores
En gallines ponedores comercials, la inclusió d’1 kg/T de paret de llevat en substitució d’un probiòtic estàndard ha mostrat un augment del 8,43 % en la producció de safates d’ous respecte a l’inici de l’assaig (vs. 5,46 % en el control), menys ous bruts (−58 %) i trencats (−15 %), amb una major proporció de safates completament netes (≈5,4 vegades més que el control) i una millor persistència de la posta després de períodes d’estrès ambiental.
A nivell intestinal, en ponedores de 65 setmanes suplementades es va observar una major relació vellositats:cripta en yeyú (augment significatiu), una reducció de la profunditat de les criptes, indicant un menor recanvi cel·lular i una millora global de l’estructura intestinal, amb potencial per a un ús més eficient de la dieta.
Aqüicultura: tilàpia del Nil
En tilàpia del Nil suplementada amb parets de llevat a 2 kg/T de pinso es va descriure un increment del guany de pes corporal d’≈18,7 % en la fase de 150–250 g respecte al control, una reducció del dipòsit de greix visceral d’≈6,2 % i un augment de l’altura de les vellositats intestinals d’≈12,6 %, cosa que es tradueix en una millor capacitat absorbent.
Aquests resultats són especialment interessants en dietes vegetals riques en polisacàrids no amilacis i potencialment més irritants per a la mucosa.
Recomanacions pràctiques d’ús
Prenent com a referència rangs d’ús habituals de parets de S. cerevisiae:
- Aves (broilers, ponedoras, reproductoras)
Habitualmente entre 0,5 y 2,0 kg/T según presión de desafío, objetivo (rendimiento, calidad de huevo, control de cama) y presencia de otros aditivos. - Porcí
Rangs similars, 1,0–2,0 kg/T, especialment en garrins i truges en transició, tot i que la dosi òptima dependrà del perfil sanitari i del programa d’additius. - Rumiants joves (vedells)
Aproximadament 4–20 g/animal/dia, en funció del pes viu i de la fase (transició llet‑starter, post‑deslletament). - Vaques de llet
Al voltant de 10 g/vaca/dia a l’inici de la lactació; les dosis específiques en prepart dependran de l’estratègia de maneig del període sec i de l’ús combinat amb altres additius (probiòtics, tamponadors, etc.). - Petits remugants
Valors orientatius de 6 g/dia per a ovelles en prepart i de 3 g/dia per a anyells, en situacions d’alta pressió d’E. coli. - Aqüicultura (peixos i gambes)
Habitualment 0,5–2,0 kg/T, segons la densitat i la qualitat de l’aigua.
Sempre hem de considerar:
- El context sanitari (historial d’enteropaties, presència de micotoxines).
- La matriu d’additius ja present (probiòtics, àcids orgànics, captaidors específics de micotoxines).
- El cost per tona en comparació amb alternatives (antibiòtics, altres moduladors de la microbiota).
Conclusió
Les parets cel·lulars de llevats representen una eina sòlida i avalada per múltiples assajos in vitro, ex vivo i in vivo per a:
- Reduir la colonització intestinal de patògens com E. coli i Salmonella mitjançant l’aglutinació mediada pels MOS.
- Modular la resposta immune innata a través dels β‑glucans, millorant la capacitat de resposta sense desencadenar inflamacions excessives.
- Adsorbir micotoxines rellevants, especialment zearalenona, complementant l’ús d’adsorbents minerals.
- Millorar l’estructura i la integritat de la mucosa intestinal, amb vellositats més altes i criptes menys profundes en aus, rumiants joves i peixos.
- Donar suport al rendiment productiu (més llet a l’inici de la lactació, més ous, millor conversió en broilers, millor creixement en tilàpia).
Per al formulador i el tècnic de camp, el repte no és només “usar parets de llevat”, sinó seleccionar fonts amb una composició ben caracteritzada, mètodes analítics robustos i evidència en les espècies i fases d’interès, i integrar-les de manera coherent en programes de salut i nutrició que busquen reduir la dependència d’antibiòtics i millorar la resiliència dels animals davant dels desafiaments sanitaris.

Bibliografia complementària
- Orlean, P. (2012). Architecture and biosynthesis of the Saccharomyces cerevisiae cell wall. Genetics, 192(3), 775‑818.
- Klis, F. M., Boorsma, A., & De Groot, P. W. J. (2006). Cell wall assembly in Saccharomyces cerevisiae. Microbiology and Molecular Biology Reviews, 70(2), 317‑343.
- Aung, M., Ohtsuka, H., & Izumi, K. (2019). Effect of yeast cell wall supplementation on production performances and blood biochemical indices of dairy cows in different lactation periods. Animal Science Journal, 90(6).
- Mahasneh, O. K. (2023). Effect of yeast cell wall on gut health, immunity and milk production of dairy cows: A review. Jordan Journal of Biological Sciences, 16(4), 569‑582.
- Ma, J., Shah, A. M., Shao, Y., Wang, Z., Zou, H., & Kang, K. (2020). Dietary supplementation of yeast cell wall improves the growth performance and gut health of weaned calves. Animal Feed Science and Technology, 269, 114623.
- Kuzmenko, O., Zavertailo, I., Kuzmenko, A., & Kropyvka, Y. (2018). Influence of mannan oligosaccharides for getting high quality and ecologically safe swine products. Ukrainian Journal of Ecology, 8(1), 780‑785.
- Grant, S. A., Rychlik, J. L., & Mellata, M. (2023). Mannan‑based prebiotics modulate growth rate and energy metabolism of Escherichia coli and impact antibiotic efficacy. Frontiers in Animal Science, 4, 1069280.
- Polidoro, B. R., et al. (2025). Mannan oligosaccharide as an alternative to in‑feed antibiotics in broiler production: A meta‑analysis. British Poultry Science.
- Adli, D. N., Muslih, A. M., & Al‑Khafaji, N. J. (2023). Effects of oligosaccharides on performance, egg quality, intestinal profile, nutrient digestibility and immunity: A meta‑analysis in laying hens. Italian Journal of Animal Science, 22(1), 2281‑2296.
- Teng, P. Y., & Kim, W. K. (2021). Effects of a combination of mannan‑oligosaccharides and β‑glucans on growth performance, intestinal development, and immune response of broilers: A review. Poultry Science, 100(4), 101176.
- Abd‑Elsamee, M. O., et al. (2021). Impact of using different sources and levels of β‑glucan and mannan oligosaccharides on broiler performance. Advances in Animal and Veterinary Sciences, 9(11), 1851‑1862.
- Plazas, R. A. S., et al. (2024). Utilization of mannan oligosaccharides as antibiotic alternatives in laying hens. Poultry Science.
- Sutthi, N., Charoenwattanasak, S., Rattanarojpong, T., & Boonanuntanasarn, S. (2020). Effects of yeast (Saccharomyces cerevisiae) on growth performance, blood chemistry and body composition of Nile tilapia (Oreochromis niloticus) under salinity stress. Iranian Journal of Fisheries Sciences, 19(6), 3050‑3068.
- Amirul, M., et al. (2025). Dietary hydrolyzed yeast improves growth, gut health, and selective gene expression of Nile tilapia (Oreochromis niloticus). Aquaculture Reports.
- Spring, P., Wenk, C., Dawson, K. A., & Newman, K. E. (2000). The effects of dietary mannanoligosaccharides on cecal parameters and the concentrations of enteric bacteria in the ceca of salmonella‑challenged broiler chicks. Poultry Science, 79(2), 205‑211.
- Vetvicka, V., & Vetvickova, J. (2015). β‑Glucans as immunomodulators in animal models. Journal of Animal and Veterinary Advances, 14, 1‑12.